
一种原位生成尺寸均匀的干细胞球的方法,用于伤口愈合。
Introduction
思路:
糖尿病伤口是一种经常遇到的与糖尿病相关的延迟愈合伤口。由于其病因和发病机制复杂,糖尿病伤口预后差、致残率高、致死率高。目前的治疗策略,如手术清创、伤口卸荷、抗感染治疗等,往往效果不充分,无法达到满意的疗效,导致复发率较高。近十年来,干细胞疗法的发展彻底改变了糖尿病伤口治疗领域,研究证明干细胞具有促再生和免疫调节特性。已证明干细胞可以通过分泌各种内源性和外源性细胞因子、发育成皮肤细胞并释放细胞外囊泡来促进细胞存活并调节炎症。通过将干细胞与生物相容性材料相结合,基于水凝胶的干细胞(水凝胶-SC)支架已被开发用于伤口治疗。这些保水细胞支架可以提供机械支撑并稳定封装的干细胞,从而增强其功能有效性。
然而,水凝胶-SC复合物的实际应用仍然受到限制。虽然水凝胶封装为干细胞提供了多种好处,但块状支架缺乏结构设计,使得精确输送和物质交换变得困难。此外,支架内分散分布的干细胞没有足够的细胞间相互作用,导致在复杂的病理环境中适应能力差,功能欠佳。因此,新的基于水凝胶的工程干细胞组合疗法仍然值得期待。
干细胞球(SP)表现出更类似于体内干细胞的形态和功能特征。此外,微针(MN)贴片是治疗皮肤病的理想给药方法。通过掺入治疗剂,例如分子药物、蛋白质、将纳米材料植入微核中,可以轻松实现治疗药物向目标部位的精确递送和持续释放。鉴于这些技术的优势,通过MN将SP输送到伤口部位在治疗延迟愈合伤口方面显示出巨大的前景。然而,传统的细胞球体制备方法存在尺寸控制不精确和大规模生产的局限性;同时,传统的MN制造方法,例如真空和离心方法,可能会导致细胞数量和功能的减少。因此,开发一种制造MN@SP的先进技术对于干细胞联合治疗的进展具有不可忽视的意义。
Fabrication of the microfluidic templated MN@SPs patch and its application in diabetic wound treatment
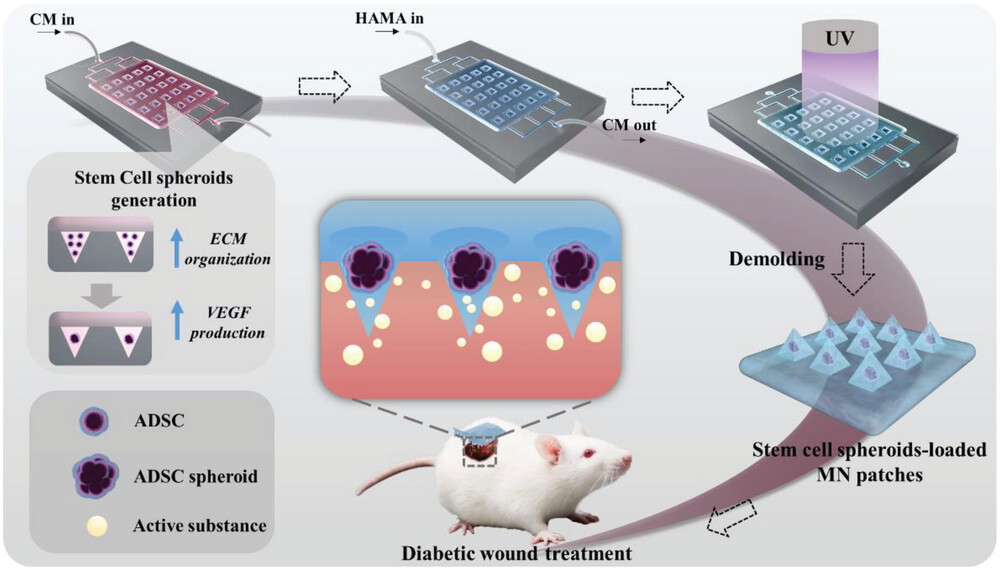
利用微流控流动将干细胞均匀分布到专门设计的微流控芯片上的微孔中,然后原位形成具有均匀形态的SP。然后,通过在微流体模板中使用相干流体交换,可以将甲基丙烯酰化透明质酸(HAMA)预凝胶溶液注入模板中,封装SP,并通过紫外光聚合。
The formation of SPs in the microfluidic template

- (a)SP形成过程示意图,包括细胞装载、细胞接种和球体形成。
- (b)用于SP形成和封装的微流控芯片模板底层的光学图像。
- (c)排列在微流控芯片模板中的微孔的代表性俯视扫描电子显微镜(SEM)图像。
- (d)排列在微流控芯片模板中的微孔的代表性横截面SEM图像。
- (e)用于SP形成和封装的整个微流控芯片模板的代表性光学显微镜图像。
- (f)微孔中形成的SP的代表性光学显微镜图像。
- (g)微孔中SP的直径分布。
The growth and gene expression characteristics of the SPs

- (a)SP在不同时间点(24、48 和 72 h)的代表性白光和荧光显微镜图像。
- (b)通过球体直径和细胞活力来量化SP的生长,观察到培养期间细胞活力的增加趋势。
- (c)ADSC形成的SP的代表性荧光显微镜图像。DAPI标记的细胞核以蓝色呈现,鬼笔环肽标记的细胞骨架以绿色呈现。
- (d)显示所有基因表达变化的火山图。
- (e)球体培养调节基因的GO富集分析。发现包括细胞外基质(ECM)组织的调节、胰岛素样生长因子(IGF)受体信号通路、血管内皮生长因子(VEGF)产生、趋化因子-介导的信号通路、血管平滑肌细胞(SMC)增殖的正调节、细胞活化的调节、结缔组织发育和信号受体活性的调节,均有上升。即3D球体培养条件增强了ECM的产生和构建,从而促进细胞活力和功能。此外,VEGF相关的基因在ADSC球体中过度表达,表明它们在伤口修复中的潜力,因为VEGF是血管生成的主要调节因子。
- (f)血管生成相关基因的热图。
- (g)ECM组织相关基因的热图。PTGS2、IGF、PDGF-D和EREG的过度表达进一步证明了SP的促血管生成作用。
- (h)通过qPCR对所选基因进行表达分析,结果与RNA-seq分析一致。
The fabrication and characteristics of MN@SPs
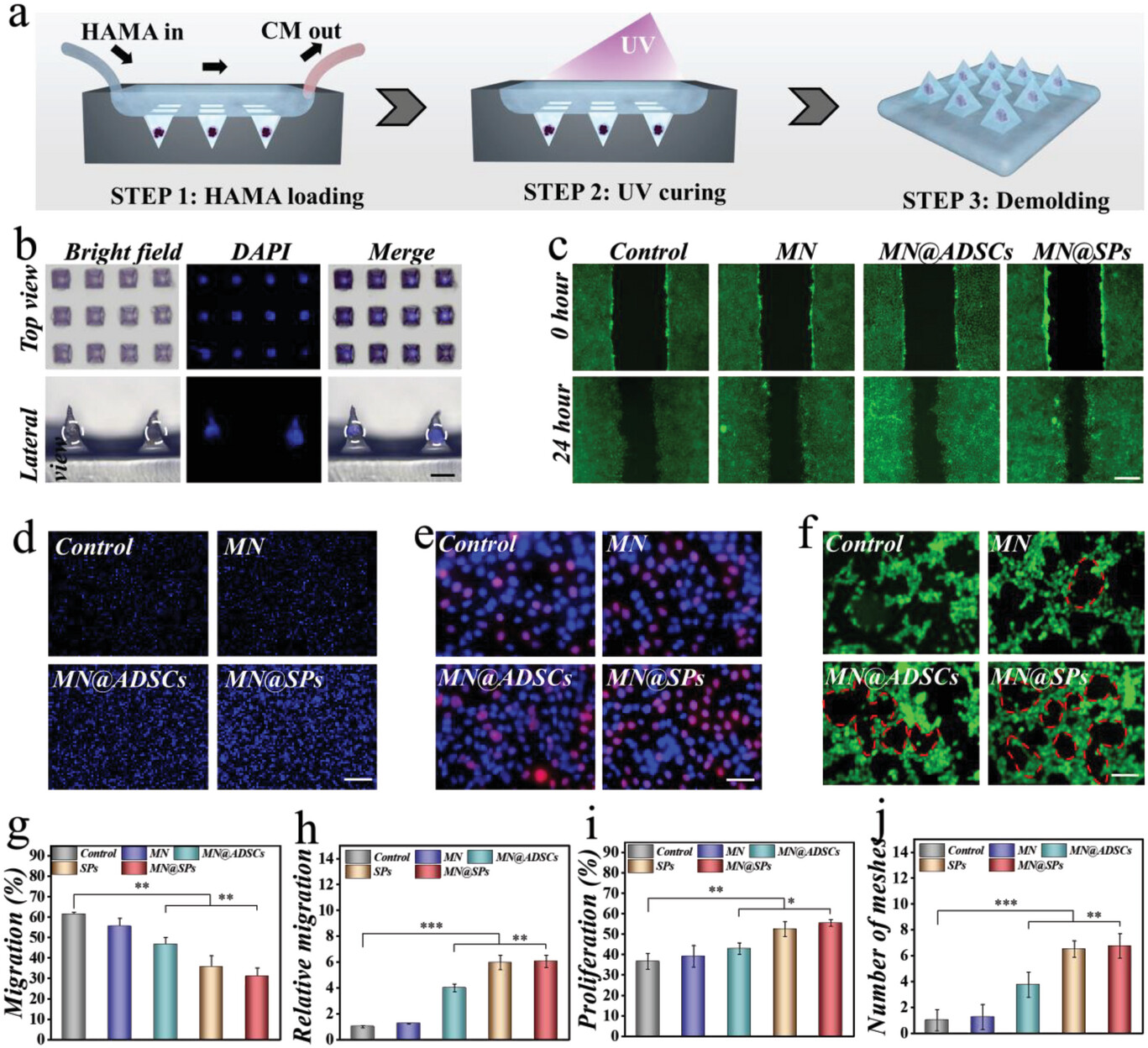
- (a)MN@SPs制造工艺示意图,包括甲基丙烯酰化透明质酸(hyaluronic acid methacryloyl,HAMA)加载、UV固化和脱模。(CM:培养基)。
- (b) MN@SPs的代表性光学和荧光显微镜图像。
- (c)不同处理的HUVEC划痕试验的代表性荧光图像。
- (d)不同处理的HUVEC中Transwell试验的代表性荧光图像。
- (e)不同处理的HUVEC中EdU增殖测定的代表性荧光图像。用EdU标记的复制细胞的细胞核以红色呈现。
- (f)不同处理的HUVEC管形成测定的荧光图像。形成的管用红色虚线标记。
- (g-j) 划痕试验、Transwell试验、EdU测定和管形成测定的定量分析。结果显示SP在促进HUVEC迁移、增殖和管形成方面具有非凡的作用。与MN@SPs组相比,球体的效果几乎不会随着封装过程而衰减。
In vivo diabetic wound healing evaluation of the MN@SPs

- (a)动物实验示意图。
- (b)第 0、3、6、9和12 d伤口的代表性光学图像。右侧显示了与光学图像对应的伤口区域追踪分析。
- (c)第12 d各组创面组织H&E染色,分段标记皮肤厚度。
- (d-e)伤口闭合动力学。MN@SPs治疗组表现出明显更快的愈合过程,并促进组织生成和重建。
- (f)组织学皮肤厚度的统计分析。MN@SPs治疗组显示皮肤厚度增加。
The angiogenesis and collagen deposition efficacy of MN@SPs effects in vivo

- (a)用CD31抗体进行免疫荧光标记的新血管系统染色的代表性图像。
- (b)第12 d伤口组织的Masson染色。
- (c)新血管密度的量化。
- (d)胶原沉积的统计分析。伤口组织的Masson三色染色与统计分析显示, MN@SPs组的胶原蛋白沉积显著增加。
Conclusion
- 提出了一种集成微流控芯片,可方便地制造MN@SPs 。该芯片能够连续生成和封装SP,从而避免细胞丢失和制备错误。
- 在细胞球培养过程中,干细胞表现出先进的细胞活力和与ECM组织和VEGF产生相关的功能。
- 鉴于SP的促再生能力,研究了MN@SP在糖尿病伤口治疗中的潜在应用。体内和体外研究均证明了MN@SPs的促血管生成能力。
- 此外,利用MN提供的增强渗透力,SP可以深入伤口床并保持其活性,从而促进血管重建和胶原蛋白沉积,促进伤口愈合。
- 总的来说,用集成微流控芯片制造的MN@SP有潜力推动干细胞治疗领域的发展,并成为用于糖尿病伤口治疗的新一代生物材料。
Reference
Wu X, Huang D, Xu Y, et al. Microfluidic Templated Stem Cell Spheroid Microneedles for Diabetic Wound Treatment[J]. Advanced Materials, 2023, 35(28): 2301064.



